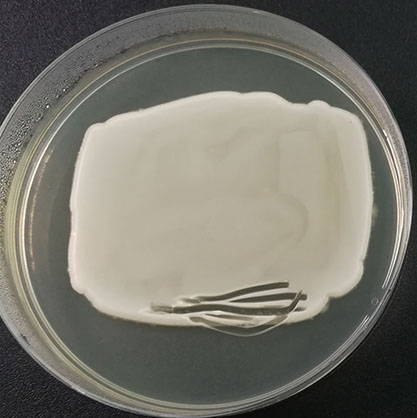
白假丝酵母基因组DNA基本信息
| 培养基 | YM培养基(英文名:YM):酵母膏 3.0g,麦芽提取物 3.0g,葡萄糖 10.0g,蛋白胨 5.0g,琼脂 20.0g(液体培养基不含),蒸馏水 1.0L,pH 6.2±0.2。121℃,15min灭菌。 |
| 传代方法 | 使用前请先在缓冲液GD和漂洗液PW中加入无水乙醇,加入体积请参照瓶上的标签; 1.取酵母细胞(最多不超过5×107cells),12,000rpm(13,400×g)离心1min,尽量吸除上清(菌液较多时可以通过几次离心将菌体沉淀收集到一个离心管中); 2.酵母细胞壁的破除:酶法:向菌体中加入600μL山梨醇buffer,加入大约50U Lyticase(客户自备,目录号:RT410),充分混匀。30℃处理30min。4000rpm(1500×g)离心10min,弃上清,收集沉淀。注意:以上为5×107酵母细胞的Lyticase用量,根据酵母的菌株和酵母细胞数量的不同,所用Lyticase的浓度和孵育时间应该进行适当调整; 3.向沉淀中加入200μL缓冲液GA重悬沉淀,充分混匀。如果需要去除RNA,可加入4μL RNase A(100mg/mL)溶液(客户自备,目录号:RT405-12),振荡15sec,室温放置5min; 4.加入20μL Proteinase K溶液,混匀; 5.加入220μL缓冲液GB,充分颠倒混匀,70℃放置10min,溶液应变清亮,简短离心以去除管盖内壁的水珠。注意:加入缓冲液GB时可能会产生白色沉淀,一般70℃放置时会消失,不会影响后续实验。如溶液未变清亮,说明细胞裂解不彻底,可能导致提取DNA量少和提取的DNA不纯; 6.加220μL无水乙醇,充分颠倒混匀,此时可能会出现絮状沉淀,简短离心以去除管盖内壁的水珠; 7.将上一步所得溶液和絮状沉淀都加入一个吸附柱CB3中(吸附柱放入收集管中),12,000rpm(13,400×g)离心30sec,倒掉废液,将吸附柱CB3放入收集管中; 8.向吸附柱CB3中加入500μL缓冲液GD(使用前请先检查是否已加入无水乙醇),12,000rpm(13,400×g)离心30sec,倒掉废液,将吸附柱CB3放入收集管中; 9.向吸附柱CB3中加入600μL漂洗液PW(使用前请先检查是否已加入无水乙醇),12,000rpm(13,400×g)离心30sec,倒掉废液,将吸附柱CB3放入收集管中; 10.重复操作步骤9; 11.将吸附柱CB3放回收集管中,12,000rpm(13,400×g)离心2min,倒掉废液。将吸附柱CB3置于室温放置数分钟,以彻底晾干吸附材料中残余的漂洗液。注意:这一步的目的是将吸附柱中残余的漂洗液去除,漂洗液中乙醇的残留会影响后续的酶反应(酶切、PCR等)实验; 12.将吸附柱CB3转入一个干净的离心管中,向吸附膜的中间部位悬空滴加50-200μL洗脱缓冲液TE,室温放置2-5min,12,000rpm(13,400×g)离心2min,将溶液收集到离心管中。注意:为增加基因组DNA的得率,可将离心得到的溶液再加入吸附柱中,室温放置2min,12,000rpm(13,400×g)离心2min。洗脱缓冲液体积不应少于50μL,体积过小影响回收效率。洗脱液的pH值对于洗脱效率有很大影响。若用ddH2O做洗脱液应保证其pH值在7.0-8.5范围内,pH值低于7.0会降低洗脱效率;且DNA产物应保存在-20℃,以防DNA降解; |
| 生长条件 | 28℃,好氧,24-48h |
| 存储条件 | 2-8℃ |
| 安全等级 | 1 |
| 应用领域 | 研究;分析检测。《消毒技术规范》规定的消毒药械对微生物杀灭效果的检定评价标准菌种。 |
| 共享方式 | 公益性共享 |



 BNCC360029 黑曲霉基因组DNA
BNCC360029 黑曲霉基因组DNA  BNCC361251 肺炎克雷伯氏菌基因组DNA
BNCC361251 肺炎克雷伯氏菌基因组DNA  BNCC352054 大肠杆菌基因组DNA
BNCC352054 大肠杆菌基因组DNA  BNCC359059 嗜肺军团菌亚种基因组DNA
BNCC359059 嗜肺军团菌亚种基因组DNA 